Lielākajai daļai cilvēku ir diezgan laba ideja par dzelzi un alumīniju, sudrabu un zeltu. Bet ir ķīmiski elementi, kuriem ir nedaudz mazāka loma mūsdienu pasaules dzīvē, taču tie ir nepelnīti maz zināmi nespeciālistu vidū. Ir svarīgi labot šo trūkumu, ieskaitot visu apgūšanu iridija.


Īpašības
Ir vērts to uzreiz pateikt iridijs ir metāls. Tāpēc tam ir visas tās īpašības, kas raksturīgas citiem metāliem. Tāds ķīmisks elements apzīmēts ar latīņu burtu kombināciju Ir. Periodiskajā tabulā viņš ņem 77 šūnas. Iridija atklāšana notika 1803. gadā kā daļa no tā paša pētījuma, kurā angļu zinātnieks Tennants izdalīja osmiju.
Izejviela šādu elementu iegūšanai bija platīna rūda, kas piegādāta no Dienvidamerikas. Sākotnēji metāli tika izolēti nogulumu veidā, ko “karaliskais degvīns” nepieņēma. Pētījums parādīja vairāku iepriekš nezināmu vielu klātbūtni. Elements saņēma tā verbālo apzīmējumu, jo tā sāļi izskatās kā zaigojoši ar varavīksni.
Iridija saturs dabā ir ārkārtīgi mazs, un šī ir viena no retākajām vielām uz Zemes.


Ķīmiski tīram irīdijam nav varavīksnes krāsas. Bet to raksturo diezgan pievilcīga sudraba-balta krāsa. Toksiskās īpašības nav apstiprinātas. Tomēr atsevišķi iridija savienojumi var būt kaitīgi cilvēkiem. Īpaši toksisks ir šī elementa fluors.
Iridija ražošanā un attīrīšanā nodarbojas vairāki Krievijas un ārvalstu uzņēmumi. Gandrīz viss šī metāla izlaidums ir platīna izejvielu blakusprodukts. Lai arī iridijs nav violets, tas dabiski satur 2 izotopus. 191. un 193. elements ir stabils.Bet izteiktas radioaktīvās īpašības, taču tai ir virkne mākslīgi iegūtu izotopu, to pussabrukšanas periods ir īss.


Īpašības
Fiziskā
Iridija stiprums un cietība ir ļoti augsta. Apstrādāt šo metālu ir gandrīz neiespējami. Ugunsizturība Šis sudrabaini baltais elements ir diezgan liels. Speciālisti Iridijs pieder pie platīna grupas. Mosa cietība ir 6,5. Kušanas temperatūra grādos sasniedz 2466 grādus. Iridijs tomēr sāk vārīties tikai pie 4428 grādiem. Saplūšanas siltums ir 27610 J / mol. Vārīšanās siltums ir 604000 J / mol. Molu tilpumu eksperti noteica 8,54 kubikmetru līmenī. redzēt uz mola.
Šī elementa kristāla režģis ir kubisks, kuba virsotnes ir kristāla virsmas. 191. izotops veido 37,3% no iridija atomiem. Atlikušos 62,3% pārstāv 193. izotops. Šī elementa blīvums (vai citādi - īpatnējais svars) sasniedz 22400 kg uz 1 m3.
Tīrā veidā metāls nav magnetizēts, un dažādu savienojumu atomu oksidācijas pakāpe svārstās no 1 līdz 6.


Ķīmiski
Bet paši irīdija atomi reti nonāk jebkāda veida reakcijā. Šis elements izceļas ar izcilu ķīmisko pasivitāti.. Tas pilnībā neizšķīst ūdenī un nekādā veidā nemainās pat ilgstošā saskarē ar gaisu. Ja vielas temperatūra ir zemāka par 100 grādiem, tad tā nereaģēs pat ar "aqua regia", nemaz nerunājot par citām skābēm un to kombinācijām. Reakcija ar fluoru ir iespējama 400 grādos, jo reakcijai ar hloru vai sēru iridijs būs jāuzsilda līdz sarkanai karstumam.
Ir zināmi 4 hlorīdi, kuros hlora atomu skaits svārstās no 1 līdz 4. Skābekļa iedarbība ir pamanāma temperatūrā, kas nav zemāka par 1000 grādiem. Šīs mijiedarbības produkts iridija dioksīds - viela, kas praktiski nešķīst ūdenī. Šķīdību var palielināt, oksidējot, izmantojot kompleksu veidojošu līdzekli. Augstāko oksidācijas līmeni normālos apstākļos var sasniegt tikai iridija heksafluorīdā.


Īpaši zemā temperatūrā parādās savienojumi ar valenci 7 un 8. Var veidoties kompleksi sāļi (gan katjonu, gan anjonu tipi). Tiek atzīmēts, ka stipri karsēts metāls var kodināt ar skābekli piesātinātu sālsskābi. Svarīgu lomu piešķir ķīmiķi:
- hidroksīdi;
- hlorīdi;
- halogenīdi;
- oksīds;
- iridija karbonilgrupas.


Kā tas tiek izrakts?
Iridija iegūšanu dabā ļoti kavē tās lielais retums. Dabiskajā vidē šis metāls vienmēr tiek sajaukts ar radniecīgām vielām. Ja šis elements ir kaut kur atrodams, tad obligāti tuvumā atrodas platīns vai tā grupas metāli. Dažās rūdās, kas satur niķeli un varu, iridijs ir izkliedēts. Šī elementa lielāko daļu iegūst no inertajām vielām:
- Dienvidāfrika
- Kanāda
- Ziemeļamerikas Kalifornijas štats;
- noguldījumi Tasmānijas salā (pieder Austrālijas savienībai);
- Indonēzija (uz Kalimantānas salas);
- dažādās Jaungvinejas teritorijas.

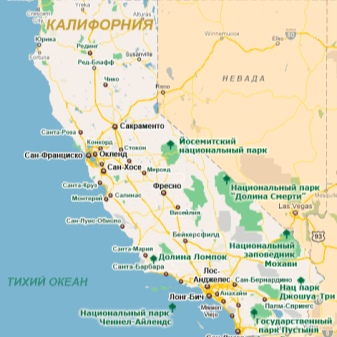
Iridiju, kas sajaukts ar osmiju, iegūst vecos kalnu krokās, kas atrodas tajās pašās valstīs. Vadošo lomu pasaules tirgū spēlē uzņēmumi no Dienvidāfrika. Ne velti ražošana šajā valstī tieši ietekmē piedāvājuma un pieprasījuma līdzsvaru, ko nevar teikt par produktiem no citiem planētas reģioniem. Saskaņā ar esošajām zinātniskajām idejām irīdija retums ir saistīts ar faktu, ka uz mūsu planētu tas nonāca tikai meteorītos, un tāpēc tas veido miljons procentus no zemes garozas masas.
Tomēr daži eksperti tam nepiekrīt. Viņi uzstāj, ka tikai neliela daļa no visiem irīdija atradnēm ir izpētīta un piemērota attīstībai mūsdienu tehnoloģiju līmenī. Noguldījumi, kas parādījās senajā ģeoloģiskajā senatnē, atsevišķos iridija slāņos satur simtiem reižu vairāk nekā jau izstrādātie ieži.
Šādas anomālijas ir sastopamas visā pasaulē.Tomēr līdz šim materiāla ieguve no dziļiem sekcijām zem kontinentiem un okeānu apakšas ir ekonomiski neracionāla.


Mūsdienās irīdiju iegūst tikai pēc galveno minerālu ieguves.. Tas ir zelts, niķelis, platīns vai varš. Kad nogulsnes ir tuvu izsīkumam, rūda sāk pārstrādāt ar īpašiem reaģentiem, kas izdala rutēniju, osmiju, pallādiju. Tikai pēc viņiem pienāk kārta saņemt “varavīksnes” elementu. Nākamais:
- tīra rūda;
- sasmalciniet to pulverī;
- nospiests šis pulveris;
- veidotās sagataves tiek pārkausētas elektriskās krāsnīs, nepārtraukti pārvietojoties ar argona strūklu.
No anoda nosēdumiem, kas palikuši vara-niķeļa ražošanā, tiek iegūts pietiekami liels metāla daudzums. Sākumā dūņas bagātina. Pārvēršana platīna un citu metālu, ieskaitot iridija, šķīdumā notiek karstā akvareģiona ietekmē. Osmijs ir neizšķīdušos nogulumos. No šķīduma amonija hlorīda ietekmē secīgi izgulsnējas platīna, iridija un rutēnija kompleksi.


Pieteikums
Apmēram 66% no ekstrahētā irīdija izmanto ķīmiskajā rūpniecībā. Visas pārējās ekonomikas nozares dala pārējo. Pēdējās desmitgadēs rotaslietas vērtība "purpursarkanā metāla" ir nepārtraukti augusi.. Kopš 1990. gadu beigām no tā laiku pa laikam ir izstrādāti gredzeni, zelta rotaslietas inkrustācijas. Svarīgi: rotaslietas tiek izgatavotas ne tik daudz no tīra iridija, cik no tā sakausējuma ar platīnu. 10% no piedevas ir pietiekami, lai palielinātu sagataves un gatavā izstrādājuma stiprību līdz 3 reizēm bez ievērojama izmaksu pieauguma.
Arī citās nozarēs iridija sakausējumi ir skaidri priekšā tīram metālam. Tehnologi ļoti augstu vērtē spēju paaugstināt produktu cietību un izturību, izmantojot nelielas piedevas. Tātad, iridija piedevas tiek izmantotas, lai palielinātu elektronisko lampu stieples nodilumizturību. Cietais metāls tiek vienkārši uzklāts virs molibdēna vai volframa. Turpmākā saķepināšana notiek zem preses, augstā temperatūrā.


Un šeit mums īpaši jāmin iridija izmantošana ķīmiskajā rūpniecībā. Tur tā sakausējumi ir nepieciešami, lai iegūtu traukus, kas izturīgi pret dažādiem reaģentiem un augstu temperatūru. Iridijs ir arī lielisks katalizators. Īpaši izteikta ir paaugstināta reaģētspēja. slāpekļskābes ražošanā. Un, ja jums ir nepieciešams izšķīdināt zeltu akvareģijā, tad tehnologiem gandrīz garantē, ka viņi tieši izvēlas tasītes, kas izgatavotas no platīna-iridija sakausējuma.
Kur viņi gatavo lāzera ierīču kristālibieži var atrast platīna iridija tīģeļi. Pilnīgi tīrs metāls ir piemērots īpaši precīzu rūpniecības un laboratorijas instrumentu detaļām. Iridija iemuti izmanto un stikliniekikad viņiem ir jāizgatavo ugunsizturīgi stikla izstrādājumi. Bet tā ir tikai neliela daļa no apbrīnojamā elementa lietojumiem.
To bieži izmanto automašīnu aizdedzes sveču ražošanā.


Eksperti jau sen ir atzīmējuši, ka šādas sveces ilgst ilgāk.. Pašā sākumā tos galvenokārt izmantoja sporta automašīnām. Mūsdienās tie ir kļuvuši lētāki un kļuvuši pieejami gandrīz visiem automašīnu īpašniekiem. Iridija sakausējumi ir nepieciešami arī radītājiem ķirurģiskie instrumenti. Arvien biežāk tos izmanto arī elektrokardiostimulatora atsevišķu daļu ražošanā.
Interesanti, ka Ruandas monēta “10 franki” ir izgatavota no tīra rotaslietas (smalkuma 999) iridija. Šis metāls tiek izmantots arī automobiļu katalizatoros. Tāpat kā platīns, tas palīdz ātrāk attīrīt izplūdes gāzes. Bet iridiju var atrast visparastākajā pildspalvas pildspalvā. Tur dažreiz var redzēt neparastas krāsas bumbiņu, kas atrodas pildspalvas vai tintes stieņa galā.

Radio komponentos iridijs galvenokārt tika izmantots pirms vairākām desmitgadēm. Biežāk no tā tika izgatavotas kontaktu grupas, kā arī komponenti, kas var būt ļoti karsti. Šis risinājums ļauj nodrošināt izstrādājumu izturību.Iridija-192 izotops ir viens no mākslīgajiem radionuklīdiem. Tas tiek ražots plaisu noteikšanai, lai pārbaudītu metinājumu, tērauda un alumīnija sakausējumu īpašības.
Lai izgatavotu osmija sakausējumu ar irīdiju kompasa adatas. Un fizikāliem pētījumiem tiek izmantoti termopāri, kas apvieno iridija un parastos elektrodus. Tikai viņi var tieši reģistrēt aptuveni 3000 grādu temperatūru. Šādu konstrukciju cena ir ļoti augsta. To izmantošana parastajā rūpniecībā pagaidām nav ekonomiski iespējama.


Irīdija titāna elektrods - Viens no salīdzinoši jaunajiem sasniegumiem elektrolīzes jomā. Ugunsizturīgu vielu izsmidzina uz titāna folijas pamatnes. Šajā gadījumā darba kamerā ir tikai argons. Elektrodi var izskatīties kā režģis vai plāksne. Šādi elektrodi:
- izturīgs pret augstu temperatūru;
- izturīgs pret ievērojamu spriegumu, blīvumu un strāvas stiprumu;
- nerūsē;
- ekonomiskāks nekā elektrodi ar pievienotu platīnu (ievērojami ilgāka resursa dēļ).

Metalurģijā ir pieprasīti mazi konteineri ar radioaktīvajiem iridija izotopiem. Gamma starus daļēji absorbē lādiņš. Tāpēc jūs varat noteikt, kāds ir uzlādes līmenis krāsns iekšpusē.
Varat arī norādīt uz tādiem 77. elementa lietojumiem kā:
- iegūstot molibdēna un volframa sakausējumus, kas stiprāki augstā temperatūrā;
- paaugstināta titāna un hroma izturība pret skābēm;
- termoelektrisko ģeneratoru ražošana;
- termisko katodu (kopā ar lantānu un cēriju) ražošana;
- degvielas tvertņu izveidošana kosmiskajām raķetēm (sakausējumā ar hafniju);
- propilēna ražošana uz metāna un acetilēna bāzes;
- platīna katalizatoru papildinājums slāpekļa oksīdu (slāpekļskābes prekursoru) ražošanai - bet šis process vairs nav tik būtisks;
- mērvienību iegūšana (precīzāk, tam nepieciešams platīna-iridija sakausējums).

Interesanti fakti
Iridija sāļi ir ļoti dažādas krāsas. Tātad, atkarībā no pievienoto hlora atomu skaita, savienojumam var būt vara sarkana, tumši zaļa, olīvu vai brūna krāsa. Irīdija difluorīds ir dzeltens. Savienojumi ar ozonu un bromu ir zilā krāsā. Tīrā irīdijā izturība pret koroziju ir ļoti augsta pat karsējot līdz 2000 grādiem.
Sauszemes iežos iridija savienojumu koncentrācija ir ļoti zema.. Tas nopietni paaugstinās tikai meteorīta iežos. Šāds kritērijs ļauj pētniekiem noteikt svarīgus faktus par dažādām ģeoloģiskām struktūrām. Kopumā uz zemes tiek ražotas tikai dažas tonnas iridija.
Šī metāla Younga modulis (pazīstams arī kā gareniskās elastības modulis) ir otrajā vietā starp zināmajām vielām (vairāk tikai grafēns).


Par citām iridija īpašībām un pielietojumu skatiet nākamo videoklipu.










