Dauguma žmonių turi gana gerą idėją apie geležį ir aliuminį, sidabrą ir auksą. Tačiau yra cheminių elementų, kurie vaidina šiek tiek mažesnį vaidmenį šiuolaikinio pasaulio gyvenime, tačiau nepelnytai yra mažai žinomi tarp nespecialistų. Svarbu ištaisyti šią ydą, įskaitant mokymąsi apie viską iridia.


Savybės
Verta pasakyti tuoj pat iridis yra metalas. Todėl jis turi visas tas savybes, kurios būdingos kitiems metalams. Toks cheminis elementas žymimas lotyniškų rašmenų deriniu Ir. Periodinėje lentelėje jis paima 77 ląstelės. Iridžio atradimas įvyko 1803 m. Kaip to paties tyrimo, kuriame anglų mokslininkas Tennantas išskyrė osmį, dalis.
Žaliava tokiems elementams gauti buvo platinos rūda, pristatyta iš Pietų Amerikos. Iš pradžių metalai buvo išskirti nuosėdų pavidalu, kurių „karališkoji degtinė“ nepriėmė. Tyrimas parodė kelių anksčiau nežinomų medžiagų buvimą. Elementas gavo žodinį žymėjimą, nes jo druskos atrodo kaip vaivorykštės rainelės.
Iridžio kiekis gamtoje yra ypač mažas, ir tai yra viena iš rečiausių medžiagų Žemėje.


Chemiškai grynas iridis neturi vaivorykštės spalvos. Tačiau jai būdinga gana patraukli sidabriškai balta spalva. Toksiškos savybės nepatvirtintos. Tačiau atskiri iridžio junginiai gali būti kenksmingi žmonėms. Šio elemento fluoras yra ypač toksiškas.
Iridžio gamyba ir tobulinimu užsiima nemažai Rusijos ir užsienio įmonių. Beveik visas šio metalo išleidimas yra šalutinis platinos žaliavų produktas. Nors iridis nėra violetinė, natūraliai jame yra 2 izotopai. 191-asis ir 193-asis elementai yra stabilūs.Bet išreikštos radioaktyviosios savybės, tačiau jis turi daugybę dirbtinai gautų izotopų, jų pusinės eliminacijos laikas yra trumpas.


Savybės
Fizinis
Iridžio stipris ir kietumas yra labai dideli. Apdoroti šį metalą yra beveik neįmanoma. Atsparumas ugniai Šis sidabriškai baltas elementas yra gana didelis. Specialistai Iridis priklauso platinos grupei. Moso kietumas yra 6,5. Lydymosi temperatūra laipsniais siekia 2466 laipsnius. Tačiau iridis pradeda virti tik esant 4428 laipsniams. Lydymosi šiluma yra 27610 J / mol. Virimo šiluma yra 604000 J / mol. Moliniai tūriai ekspertai nustatė 8,54 kubinio metro lygį. žiūrėti už molį.
Šio elemento kristalinė gardelė yra kubinė, kubo viršūnės yra krištolo formos. 191-asis izotopas sudaro 37,3% iridžio atomų. Likusius 62,3% sudaro 193-asis izotopas. Šio elemento tankis (arba kitaip, savitasis sunkis) siekia 22400 kg / 1 m3.
Savo gryna forma metalas nėra įmagnetintas, o įvairių junginių atomų oksidacijos laipsnis svyruoja nuo 1 iki 6.


Cheminė
Bet patys iridžio atomai retai kada patiria bet kokią reakciją. Šis elementas išsiskiria išskirtiniu cheminiu pasyvumu.. Jis visiškai netirpsta vandenyje ir niekaip nesikeičia net ilgai užsitęsus sąlyčiui su oru. Jei medžiagos temperatūra yra žemesnė nei 100 laipsnių, tada ji nereaguos net su „aqua regia“, jau nekalbant apie kitas rūgštis ir jų derinius. Reakcija su fluoru galima 400 laipsnių kampu, nes reakcija su chloru arba siera turės sušildyti iridį iki raudonos šilumos.
Yra žinomi 4 chloridai, kuriuose chloro atomų skaičius svyruoja nuo 1 iki 4. Deguonies poveikis pastebimas ne žemesnėje kaip 1000 laipsnių temperatūroje. Šios sąveikos produktas yra iridžio dioksidas - medžiaga, praktiškai netirpi vandenyje. Tirpumą galima padidinti oksidacijos būdu naudojant kompleksą sudarančią medžiagą. Aukščiausią oksidacijos būseną normaliomis sąlygomis galima pasiekti tik iridžio heksafluoride.


Ypač žemoje temperatūroje atsiranda junginių, kurių valentingumas yra 7 ir 8. Gali susidaryti kompleksinės druskos (tiek katijoninės, tiek anijoninės). Pastebima, kad stipriai kaitinamas metalas gali korozuoti druskos rūgštimi, prisotinta deguonimi. Svarbų vaidmenį atlieka chemikai:
- hidroksidai;
- chloridai;
- halogenidai;
- oksidas;
- iridžio karbonilų.


Kaip jis iškasamas?
Gauti iridį gamtoje labai trukdo jo didžiulė retenybė. Natūralioje aplinkoje šis metalas visada maišomas su susijusiomis medžiagomis. Jei šis elementas randamas kažkur, tada būtinai šalia yra platina ar jos grupės metalai. Kai kurios rūdos, turinčios nikelio ir vario, apima iridžio disperguotą formą. Didžioji šio elemento dalis yra išgaunama iš inertinių medžiagų:
- Pietų Afrika
- Kanada
- Šiaurės Amerikos Kalifornijos valstija;
- indėliai Tasmanijos saloje (priklauso Australijos sąjungai);
- Indonezija (Kalimantano saloje);
- skirtingos Naujosios Gvinėjos sritys.

Iridis, sumaišytas su osmijumi, iškasamas senuose kalnuose, esančiuose tose pačiose šalyse. Pagrindinį vaidmenį pasaulinėje rinkoje vaidina įmonės iš Pietų Afrika. Ne veltui šios šalies gamyba tiesiogiai veikia pasiūlos ir paklausos pusiausvyrą, ko negalima pasakyti apie produktus iš kitų planetos regionų. Remiantis turimomis mokslinėmis idėjomis, iridžio retumas yra dėl to, kad jis į mūsų planetą atkeliavo tik meteorituose, todėl jis sudaro milijoninę procentą žemės plutos masės.
Tačiau kai kurie ekspertai su tuo nesutinka. Jie reikalauja, kad tik nedidelė visų iridžio telkinių dalis būtų ištirta ir tinkama plėtoti šiuolaikinių technologijų lygiu. Senovės geologinėje antikoje atsiradusių indėlių šimtuose kartų daugiau yra atskiruose iridžio sluoksniuose nei jau išsivysčiusiose uolienose.
Tokios anomalijos aptinkamos visame pasaulyje.Tačiau kol kas medžiagos gavyba iš gilių sekcijų po žemynais ir vandenynų dugnu yra ekonomiškai neracionali.


Šiandien iridis iškasamas tik išgavus pagrindinius mineralus.. Tai auksas, nikelis, platina arba varis. Kai nuosėdos beveik išsenka, rūda pradeda perdirbti specialiais reagentais, kurie išskiria rutenį, osmį, paladžio. Tik po jų ateina eilė gauti „vaivorykštės“ elementą. Kitas:
- švari rūda;
- sutrinkite į miltelius;
- suspausti šie milteliai;
- formuoti ruošiniai perlydomi elektrinėse krosnyse, nuolat judant argono srove.
Iš anodo dumblo, likusio vario-nikelio gamyboje, išgaunamas pakankamai didelis metalo kiekis. Iš pradžių dumblas praturtėja. Karšto vandens regia daro įtaką platinos ir kitų metalų, įskaitant iridį, tirpalui. Osmis yra neištirpusiose nuosėdose. Iš tirpalo, nusodinant amonio chloridą, iš eilės iškrinta platinos, iridžio ir rutenio kompleksai.


Taikymas
Apie 66% išgauto iridžio naudojami chemijos pramonėje. Visus kitus ekonomikos sektorius dalija likusi dalis. Pastaraisiais dešimtmečiais papuošalų „purpurinis metalas“ vertė stabiliai auga.. Nuo dešimtojo dešimtmečio pabaigos iš jo kartais buvo kuriami žiedai, aukso papuošalų inkrustacijos. Svarbu: papuošalai gaminami ne tiek iš gryno iridžio, kiek iš jo lydinio su platina. 10% priedo pakanka, kad ruošinio ir gatavo produkto stiprumas padidėtų iki 3 kartų, nemažėjant sąnaudoms.
Kitose pramonės šakose iridžio lydiniai taip pat aiškiai lenkia gryną metalą. Technologai labai vertina galimybę padidinti produktų kietumą ir stiprumą naudojant nedidelius priedus. Taigi, iridžio priedai yra naudojami elektroninių lempų vielos atsparumui dilimui padidinti. Kietasis metalas tiesiog tepamas ant molibdeno ar volframo. Vėliau sukepinamas spaudžiant aukštoje temperatūroje.


Ir čia turime ypač paminėti iridžio naudojimą chemijos pramonėje. Ten jo lydiniai reikalingi norint gauti indus, atsparius įvairiems reagentams ir aukštą temperatūrą. Iridis taip pat yra puikus katalizatorius. Padidėjęs reaktyvumas yra ypač akivaizdus. gaminant azoto rūgštį. Ir jei jums reikia ištirpinti auksą vandens regijoje, tada technologams beveik garantuojama, kad jie pasirinks būtent puodelius, pagamintus iš platinos iridžio lydinio.
Kur jie gamina maistą lazerinių prietaisų kristalaidažnai galima rasti platinos iridžio tigliai. Visiškai grynas metalas tinka ypač tikslių pramoninių ir laboratorinių prietaisų dalims. Iridžio kandiklis naudojamas ir ledynaikai jiems reikia pagaminti ugniai atsparų stiklo laipsnį. Bet tai tik nedidelė nuostabaus elemento taikymo dalis.
Jis dažnai naudojamas automobilių uždegimo žvakių gamyboje.


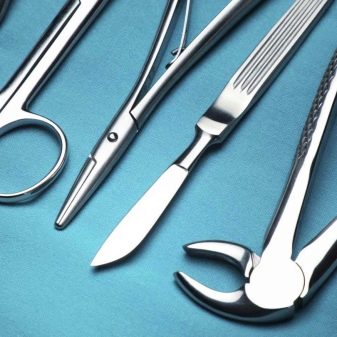
Ekspertai jau seniai pažymėjo, kad tokios žvakės tarnauja ilgiau.. Pačioje pradžioje jie buvo naudojami daugiausia sportiniams automobiliams. Šiandien jie tapo pigesni ir tapo prieinami beveik visiems automobilių savininkams. Iridžio lydiniai taip pat reikalingi kūrėjams chirurginiai instrumentai. Jie vis dažniau naudojami gaminant atskiras širdies stimuliatoriaus dalis.
Įdomu, kad Ruandos moneta „10 frankų“ yra pagaminta iš gryno juvelyrikos (999 prabos) iridžio. Šis metalas taip pat naudojamas automobilių katalizatoriuose. Kaip ir platina, jis padeda greičiau išvalyti išmetamuosius dūmus. Bet iridžio galite rasti paprasčiausiame užpildytame rašiklyje. Ten kartais galite pamatyti neįprastos spalvos rutulį, esantį ant rašiklio ar rašalo lazdelės galiuko.

Radijo komponentuose iridis buvo naudojamas daugiausia prieš kelis dešimtmečius. Iš jos dažniau buvo gaminamos kontaktinės grupės, taip pat komponentai, kurie gali būti labai karšti. Šis sprendimas leidžia užtikrinti gaminių patvarumą.Iridžio-192 izotopas yra vienas iš dirbtinių radionuklidų. Jis gaminamas trūkumams aptikti, norint patikrinti suvirinimo siūlių, plieno ir aliuminio lydinių savybes.
Gamybai naudojamas osmio lydinys su iridžiu kompaso adatos. Fiziniams tyrimams naudojami termoelementai, kurie sujungia iridį ir įprastus elektrodus. Tik jie gali tiesiogiai užregistruoti apie 3000 laipsnių temperatūrą. Tokių konstrukcijų kaina yra labai aukšta. Juos naudoti įprastoje pramonėje dar nėra ekonomiškai įmanoma.


Iridžio titano elektrodas - Vienas iš palyginti naujų pokyčių elektrolizės srityje. Ugniai atspari medžiaga purškiama ant titano folijos pagrindo. Šiuo atveju darbo kameroje yra tik argonas. Elektrodai gali atrodyti kaip tinklelis ar plokštė. Tokie elektrodai:
- atsparus aukštai temperatūrai;
- atsparus reikšmingai įtampai, tankiui ir srovės stiprumui;
- neerzinti;
- ekonomiškesni nei elektrodai, į kuriuos pridėta platinos (dėl žymiai ilgesnio resurso).

Metalurgijoje yra paklausa mažų konteinerių su radioaktyviosiomis iridžio izotopais. Gama spindulius iš dalies absorbuoja krūvis. Todėl galite nustatyti, koks yra krūvio lygis krosnies viduje.
Taip pat galite nurodyti tokius 77-ojo elemento pritaikymus kaip:
- gauti molibdeno ir volframo lydinius, stipresnius esant aukštai temperatūrai;
- padidėjęs titano ir chromo atsparumas rūgštims;
- termoelektrinių generatorių gamyba;
- termioninių katodų (kartu su lantanu ir ceriu) gamyba;
- kuro bakų kosminėms raketoms sukūrimas (lydinyje su hafniu);
- propileno, kurio pagrindą sudaro metanas ir acetilenas, gamyba;
- platinos katalizatorių, skirtų azoto oksidams (azoto rūgšties pirmtakams) gaminti, papildymas, tačiau šis procesas nebėra labai tinkamas;
- gauti pamatinius matavimo vienetus (tiksliau, tam reikia platinos iridžio lydinio).

Įdomūs faktai
Iridžio druskos yra labai įvairios spalvos. Taigi, atsižvelgiant į prijungtų chloro atomų skaičių, junginys gali būti vario raudonos, tamsiai žalios, alyvuogių arba rudos spalvos. Iridžio difluoridas yra geltonos spalvos. Junginiai su ozonu ir bromu yra mėlynos spalvos. Gryno iridžio atsparumas korozijai yra labai didelis net kaitinant iki 2000 laipsnių.
Antžeminėse uolienose iridžio junginių koncentracija yra labai maža.. Jis rimtai kyla tik meteorito uolienose. Toks kriterijus leidžia tyrėjams nustatyti svarbius faktus apie įvairias geologines struktūras. Iš viso žemėje pagaminama tik kelios tonos iridžio.
Šio metalo Youngo modulis (dar žinomas kaip išilginio tamprumo modulis) yra antroje vietoje tarp žinomų medžiagų (daugiau tik grafeno).


Apie kitas iridžio savybes ir pritaikymą žiūrėkite kitame vaizdo įraše.










