Većina ljudi ima prilično dobru ideju o željezu i aluminiju, srebru i zlatu. Ali postoje kemijski elementi koji igraju malo manju ulogu u životu suvremenog svijeta, ali su među nespecijalcima nezasluženo malo poznati. Važno je ispraviti ovaj nedostatak, uključujući učenje o svemu iridijum.


Značajke
Vrijedi to odmah reći iridium je metal. Stoga ima sva ona svojstva koja su tipična za ostale metale. Takav kemijski element označen kombinacijom latiničnih slova Ir. U periodičnoj tablici uzima 77 stanica. Otkrivanje iridija dogodilo se 1803. godine, kao dio iste studije u kojoj je engleski znanstvenik Tennant izolirao osmij.
Sirovina za dobivanje takvih elemenata bila je platinasta ruda, isporučena iz Južne Amerike. U početku su metali izolirani u obliku sedimenata, koje "kraljevska votka" nije uzimala. Studija je pokazala prisutnost nekoliko nepoznatih tvari. Element je dobio svoju verbalnu oznaku jer njegove soli izgledaju kao da su iridescentne duginom.
Sadržaj iridija u prirodi je izuzetno mali, a ovo je jedna od najrjeđih tvari na Zemlji.


Kemijski čisti iridij nema duginu boju. Ali karakterizira ga prilično atraktivna srebrno bijela boja. Toksična svojstva nisu potvrđena. Međutim, pojedinačni spojevi iridija mogu biti štetni za ljude. Fluor ovog elementa je posebno toksičan.
Mnoga ruska i strana poduzeća bave se proizvodnjom i rafiniranjem iridija. Gotovo čitavo izdanje ovog metala nusproizvod je platinastih sirovina. Iako iridij nije ljubičaste boje, prirodno sadrži 2 izotopa. Elementi iz 191. i 193. stabilni su.Ali izražena radioaktivna svojstva, ali ona ima niz umjetno dobivenih izotopa, njihov poluživot je kratak.


Svojstva
fizička
Čvrstoća i tvrdoća iridija su vrlo visoke. Obrada ovog metala gotovo je nemoguća. infusibility Ovaj srebrno bijeli element prilično je velik. stručnjaci Iridium pripada skupini platina. Mohsova tvrdoća je 6,5. Talište u stupnjevima doseže 2466 stupnjeva. Iridium, međutim, počinje ključati tek na 4428 stupnjeva. Toplina fuzije je 27610 J / mol. Toplina vrenja je 604000 J / mol. Molarni volumen utvrdili su stručnjaci na razini od 8,54 kubika. vidi po molu.
Kristalna rešetka ovog elementa je kubična, a vrhovi kocke su kristalna lica. 191. izotop čini 37,3% atoma iridija. Preostalih 62,3% predstavljeno je 193. izotopom. Gustoća ovog elementa (ili drugačije specifične težine) doseže 22400 kg po 1 m3.
U svom čistom obliku metal se ne magnetizira, a stupanj oksidacije atoma u raznim spojevima kreće se od 1 do 6.


kemijski
Ali sami atomi iridija rijetko upadaju u bilo kakve reakcije. Ovaj element odlikuje se izvanrednom kemijskom pasivnošću., Potpuno se ne rastvara u vodi i ne mijenja se ni na koji način čak ni kod dužeg kontakta sa zrakom. Ako je temperatura tvari niža od 100 stupnjeva, tada neće reagirati čak ni s "aqua regia", a da ne spominjemo ostale kiseline i njihove kombinacije. Reakcija s fluorom moguća je na 400 stupnjeva, jer će reakcija s klorom ili sumporom morati ugrijati iridij do crvene topline.
Poznata su 4 klorida u kojima broj atoma klora varira od 1 do 4. Učinak kisika uočljiv je na temperaturi ne nižoj od 1000 stupnjeva. Proizvod ove interakcije je iridijev dioksid - tvar koja je praktički netopljiva u vodi. Topljivost se može povećati oksidacijom upotrebom kompleksa. Najveće stanje oksidacije u normalnim uvjetima može se postići samo u iridijevom heksafluoridu.


Pri ekstremno niskim temperaturama pojavljuju se spojevi s valencijama 7 i 8. Mogu se formirati složene soli (i kationskih i anionskih). Primijećeno je da snažno zagrijani metal može nagrizati klorovodična kiselina zasićena kisikom. Kemičari imaju važnu ulogu:
- hidroksidi;
- kloridi;
- halida;
- oksid;
- iridium karbonili.


Kako se minira?
Dobivanje iridija u prirodi uvelike ometa njegovu veliku rijetkost. U prirodnom okruženju ovaj se metal uvijek miješa sa srodnim tvarima. Ako se ovaj element negdje nađe, tada su platina ili metali iz njegove skupine nužno u blizini. Neke rude koje sadrže nikl i bakar uključuju iridij u dispergiranom obliku. Glavni dio ovog elementa izvlači se iz inertne tvari u:
- Južna Afrika
- Kanada;
- Sjevernoamerička država Kalifornija;
- naslage na otoku Tasmaniji (u vlasništvu Australijske unije);
- Indonezija (na otoku Kalimantan);
- različita područja Nove Gvineje.

Iridij pomiješan s osmijem minira se u starim planinskim naborima smještenim u istim zemljama. Vodeću ulogu na globalnom tržištu igraju kompanije iz Južna Afrika, Nije uzalud da proizvodnja u ovoj zemlji izravno utječe na ravnotežu ponude i potražnje, što se ne može reći za proizvode iz drugih regija planete. Prema postojećim znanstvenim idejama, rijetkost iridija nastaje zbog činjenice da je na naš planet stigao samo u meteoritima, i stoga on čini milijun posto mase zemljine kore.
Međutim, neki se stručnjaci s tim ne slažu. Inzistiraju na tome da se samo mali dio svih iridijevih ležišta istražuje i pogodno je za razvoj na razini moderne tehnologije. Naslage koje su se pojavile u drevnoj geološkoj antici sadrže stotine puta više u odvojenim slojevima iridija od već razvijenih stijena.
Takve se anomalije nalaze diljem svijeta.Međutim, vađenje materijala iz dubokih dijelova ispod kontinenata i na dnu oceana zasad je ekonomski neracionalno.


Danas se iridij minira tek nakon vađenja glavnih minerala., To je zlato, nikal, platina ili bakar. Kad se talog nalazi blizu iscrpljenosti, ruda počinje obrađivati posebne reagense koji oslobađaju rutenij, osmij, paladij. Tek nakon njih dolazi red primanja elementa „duga“. Sljedeća:
- čista ruda;
- zdrobiti ga u prah;
- pritisnuo ovaj prah;
- oblikovani radni dijelovi ponovo se toče u električnim pećima, uz kontinuirano kretanje mlaznice argona.
Dovoljno velika količina metala izvlači se iz mulja anode koji je preostao proizvodnjom bakra i nikla. U početku se mulj obogaćuje. Prevođenje u otopinu platine i drugih metala, uključujući iridij, događa se pod utjecajem vruće aqua regia. Osmij je u nerazrijeđenom sedimentu. Kompleksi platine, iridija i rutenija sukcesivno se talože iz otopine pod djelovanjem amonijevog klorida.


primjena
Oko 66% ekstrahiranog iridija koristi se u kemijskoj industriji, Svi ostali sektori gospodarstva dijele ostatak. Posljednjih desetljeća vrijednost nakita od "ljubičastog metala" neprestano raste., Od kraja 1990-ih iz nje se povremeno razvijaju prstenovi, umetnuti zlatni nakit. Važno: nakit se izrađuje ne toliko od čistog iridija, koliko od njegove legure s platinom. 10% aditiva je dovoljno za povećanje čvrstoće obratka i gotovog proizvoda do 3 puta bez značajnog povećanja troškova.
U drugim industrijama, legure iridija također su očigledno ispred čistog metala. Tehnolozi visoko prihvaćaju sposobnost povećanja tvrdoće i čvrstoće proizvoda putem manjih aditiva. Dakle, aditivi iridija koriste se za povećanje otpornosti na trošenje žica za elektroničke svjetiljke. Čvrsti metal jednostavno se nanosi preko molibdena ili volframa. Naknadno sinteriranje događa se pod prešom, na visokoj temperaturi.


I ovdje moramo posebno spomenuti uporabu iridija u kemijskoj industriji. Tamo su njegove legure potrebne za dobivanje jela otpornog na razne reagense i visoke temperature. Iridium je također odličan katalizator. Povišena reaktivnost je posebno vidljiva. u proizvodnji dušične kiseline, A ako trebate otopiti zlato u aqua regia, tada su tehnološki gotovo zagarantirani da odaberu točno čaše od legure platine-iridija.
Gdje kuhaju kristali za laserske uređaječesto se mogu naći platninski iridijevi lonci. Potpuno čisti metal pogodan je za dijelove posebno preciznih industrijskih i laboratorijskih instrumenata. Upotrebljava se iridijin usta i staklarikad trebaju napraviti vatrostalne stupnjeve stakla. Ali ovo je samo mali dio primjena nevjerojatnog elementa.
Često se koristi u proizvodnji svjećica za automobile.


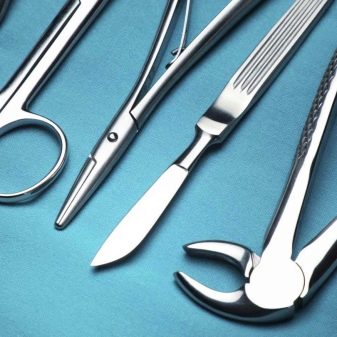
Stručnjaci već dugo primjećuju da takve svijeće traju duže., Na samom početku korišteni su uglavnom za sportske automobile. Danas su pojeftinili i postali su dostupni gotovo svim vlasnicima automobila. Iritijeve legure također su potrebne tvorcima kirurški instrumenti, Sve se češće koriste i u proizvodnji pojedinih dijelova pejsmejkera.
Zanimljivo je da je novčić „10 franaka“, proizveden u Ruandi, izrađen od čistog iridija razreda 9 nakita. Ovaj se metal također koristi u automobilskim katalizatorima. Kao i platina, ona pomaže bržem čišćenju ispušnih plinova. Ali iridij možete pronaći u najobičnijoj nalivperu. Tamo ponekad možete vidjeti kuglu neobične boje, koja se nalazi na vrhu olovke ili šipke s tintom.

U radio komponentama iridij se koristio uglavnom prije nekoliko desetljeća. Kontaktne skupine, kao i komponente koje mogu biti vrlo vruće, izrađivane su od njega češće. Ovo rješenje omogućava osigurati trajnost proizvoda.Izotop iridium-192 jedan je od umjetnih radionuklida. Izrađuje se za otkrivanje kvarova za provjeru karakteristika zavara, čelika i aluminijskih legura.
Za izradu se koristi legura osmija s iridijem kompasne igle. A termoelementi, koji kombiniraju iridij i konvencionalne elektrode, koriste se za fizička istraživanja. Samo oni mogu izravno registrirati temperaturu od oko 3000 stupnjeva. Cijena takvih konstrukcija vrlo je visoka. Koristiti ih u uobičajenoj industriji još nije ekonomski izvedivo.


Iridijev titanov elektroda - Jedno od relativno novih dostignuća na polju elektrolize. Vatrostalna tvar se raspršuje na bazu od titanijeve folije. U ovom slučaju u radnoj komori je samo argon. Elektrode mogu izgledati poput rešetke ili ploče. Takve elektrode:
- otporan na visoke temperature;
- otporan na značajan napon, gustoću i jačinu struje;
- ne korodiraju;
- ekonomičniji od elektroda s dodatkom platine (zbog znatno duljeg resursa).

Mali metalni spremnici s radioaktivnim izotopima iridija potraženi su u metalurgiji. Gama zrake djelomično se apsorbiraju nabojem. Stoga možete odrediti koja je razina naboja unutar peći.
Možete upozoriti i na takve aplikacije 77. elementa kao što su:
- dobivanje legura molibdena i volframa, jače na visokoj temperaturi;
- povećana otpornost titana i kroma na kiseline;
- proizvodnja termoelektričnih generatora;
- proizvodnja termionskih katoda (zajedno s lantanom i cerijem);
- stvaranje spremnika za gorivo za svemirske rakete (u leguri s hafnijem);
- proizvodnja propilena na bazi metana i acetilena;
- dodatak platinskim katalizatorima za proizvodnju dušikovih oksida (prekursori dušične kiseline) - ali taj postupak više nije vrlo bitan;
- dobivanje referentnih mjernih jedinica (točnije, ovo zahtijeva legura platina-iridij).

Zanimljive činjenice
Iridijeve soli su vrlo raznolike u boji. Dakle, ovisno o broju vezanih atoma klora, spoj može imati bakreno crvenu, tamno zelenu, maslinastu ili smeđu boju. Iridijev difluorid je žut. Spojevi s ozonom i bromom su plave boje. U čistom iridijumu, otpornost na koroziju je vrlo visoka čak i kada se zagrijava na 2000 stupnjeva.
U zemaljskim stijenama koncentracija iridijevih spojeva je vrlo niska., Raste ozbiljno samo u stijenama meteorita. Takav kriterij omogućuje istraživačima utvrđivanje važnih činjenica o različitim geološkim strukturama. Ukupno, na zemlji se proizvede samo nekoliko tona iridija.
Youngov modul (aka modul uzdužne elastičnosti) ovog metala nalazi se na drugom mjestu među poznatim tvarima (više samo grafen).


O ostalim svojstvima i primjeni iridija pogledajte sljedeći videozapis.










