La mayoría de la gente tiene una idea bastante buena de hierro y aluminio, plata y oro. Pero hay elementos químicos que juegan un papel un poco más pequeño en la vida del mundo moderno, pero son inmerecidamente poco conocidos entre los no especialistas. Es importante corregir esta falla, incluso aprender todo sobre iridia.


Caracteristicas
Vale la pena decir de inmediato que El iridio es un metal. Por lo tanto, tiene todas esas propiedades que son típicas de otros metales. Tal elemento químico denotado por una combinación de caracteres latinos Ir. En la tabla periódica, toma 77 celdas. El descubrimiento del iridio se produjo en 1803, como parte del mismo estudio en el que el científico inglés Tennant aisló el osmio.
La materia prima para obtener tales elementos fue el mineral de platino, entregado desde América del Sur. Inicialmente, los metales se aislaron en forma de sedimento, que el "vodka real" no tomó. El estudio mostró la presencia de varias sustancias previamente desconocidas. El elemento recibió su designación verbal porque sus sales parecen iridiscentes con un arco iris.
El contenido de iridio en la naturaleza es extremadamente pequeño, y esta es una de las sustancias más raras de la Tierra.


El iridio químicamente puro no tiene color del arco iris. Pero se caracteriza por un color blanco plateado bastante atractivo. Propiedades tóxicas no confirmadas. Sin embargo, los compuestos de iridio individuales pueden ser dañinos para los humanos. El fluoruro de este elemento es especialmente tóxico.
Varias empresas rusas y extranjeras se dedican a la producción y refinación de iridio. Casi todo el lanzamiento de este metal es un subproducto de las materias primas de platino. Aunque el iridio no es púrpura, naturalmente contiene 2 isótopos. Los elementos 191 y 193 son estables.Pero expresa propiedades radiactivas, pero tiene una serie de isótopos obtenidos artificialmente, su vida media es corta.


Las propiedades
Fisico
La resistencia y la dureza del iridio son muy altas. Mecanizar este metal es casi imposible. Refractariedad Este elemento blanco plateado es bastante grande. Especialistas Iridium pertenece al grupo de platino. La dureza de Mohs es 6.5. El punto de fusión en grados alcanza 2466 grados. El iridio, sin embargo, comienza a hervir solo a 4428 grados. El calor de fusión es 27610 J / mol. El calor de ebullición es 604000 J / mol. El volumen molar fue determinado por expertos a un nivel de 8,54 metros cúbicos. ver por mole.
La red cristalina de este elemento es cúbica; los vértices del cubo son caras de cristal. El 191º isótopo representa el 37,3% de los átomos de iridio. El 62,3% restante está representado por el 193º isótopo. La densidad de este elemento (o de lo contrario, la gravedad específica) alcanza 22400 kg por 1 m3.
En su forma pura, el metal no está magnetizado, y el grado de oxidación de los átomos en varios compuestos varía de 1 a 6.


Quimico
Pero los átomos de iridio en sí rara vez entran en algún tipo de reacción. Este elemento se distingue por su excelente pasividad química.. No se disuelve por completo en agua y no cambia de ninguna manera, incluso con un contacto prolongado con el aire. Si la temperatura de la sustancia es inferior a 100 grados, no reaccionará incluso con "aqua regia", sin mencionar otros ácidos y sus combinaciones. La reacción con flúor es posible a 400 grados, ya que la reacción con cloro o azufre tendrá que calentar el iridio a rojo.
Se conocen 4 cloruros en los que el número de átomos de cloro varía de 1 a 4. El efecto del oxígeno es notable a una temperatura no inferior a 1000 grados. El producto de esta interacción es el dióxido de iridio, una sustancia que es prácticamente insoluble en agua. La solubilidad puede aumentarse por oxidación usando un agente complejante. El estado de oxidación más alto en condiciones normales se puede lograr solo en hexafluoruro de iridio.


A temperaturas extremadamente bajas, aparecen compuestos con valencias de 7 y 8. Se pueden formar sales complejas (tanto catiónicas como aniónicas). Se observa que el metal fuertemente calentado puede corroer el ácido clorhídrico saturado con oxígeno. Los químicos dan un papel importante:
- hidróxidos;
- cloruros;
- haluros
- óxido;
- carbonatos de iridio.


¿Cómo se extrae?
La obtención de iridio en la naturaleza se ve muy obstaculizada por su gran rareza. En el entorno natural, este metal siempre se mezcla con sustancias relacionadas. Si este elemento se encuentra en algún lugar, entonces el platino o los metales de su grupo están necesariamente cerca. Algunos minerales que contienen níquel y cobre incluyen iridio en forma dispersa. La parte principal de este elemento se extrae de la materia inerte en:
- Sudáfrica
- Canadá
- Estado norteamericano de California;
- depósitos en la isla de Tasmania (propiedad de la Unión Australiana);
- Indonesia (en la isla de Kalimantan);
- diferentes zonas de Nueva Guinea.

El iridio mezclado con osmio se extrae en viejos pliegues de montaña ubicados en los mismos países. El papel principal en el mercado global lo desempeñan empresas de Sudáfrica. No en vano, la producción en este país afecta directamente el equilibrio de la oferta y la demanda, lo que no se puede decir de los productos de otras regiones del planeta. Según las ideas científicas existentes, la rareza del iridio se debe al hecho de que solo llegó a nuestro planeta en meteoritos y, por lo tanto, representa una millonésima parte del porcentaje de la masa de la corteza terrestre.
Sin embargo, algunos expertos no están de acuerdo con esto. Insisten en que solo una pequeña parte de todos los depósitos de iridio se explora y es adecuada para el desarrollo a nivel de tecnología moderna. Los depósitos que aparecieron en la antigüedad geológica antigua contienen cientos de veces más en capas separadas de iridio que las rocas ya desarrolladas.
Tales anomalías se encuentran en todo el mundo.Sin embargo, la extracción de material de secciones profundas debajo de los continentes y en el fondo de los océanos es hasta ahora económicamente irracional.


Hoy en día, el iridio se extrae solo después de la extracción de los principales minerales.. Es oro, níquel, platino o cobre. Cuando el depósito está cerca del agotamiento, el mineral comienza a procesarse con reactivos especiales que liberan rutenio, osmio y paladio. Solo después de ellos llega el turno de recibir un elemento "arcoiris". Siguiente:
- mineral limpio;
- aplastarlo en polvo;
- prensado este polvo;
- Las piezas moldeadas se vuelven a fundir en hornos eléctricos, con el movimiento continuo de un chorro de argón.
Se extrae una cantidad suficientemente grande de metal del lodo anódico que deja la producción de cobre y níquel. Inicialmente, los lodos enriquecen. La traducción a una solución de platino y otros metales, incluido el iridio, se produce bajo la influencia de la agua caliente de la región. El osmio está en sedimento no disuelto. Los complejos de platino, iridio y rutenio se precipitan sucesivamente de una solución bajo la acción del cloruro de amonio.


Solicitud
Alrededor del 66% del iridio extraído utilizado en la industria química. Todos los demás sectores de la economía comparten el resto. En las últimas décadas, el valor de la joyería del "metal púrpura" ha estado creciendo constantemente.. Desde finales de la década de 1990, ocasionalmente se han desarrollado anillos con incrustaciones de joyas de oro. Importante: las joyas están hechas no tanto de iridio puro como de su aleación con platino. El 10% del aditivo es suficiente para aumentar la resistencia de la pieza de trabajo y el producto terminado hasta 3 veces sin un aumento significativo en el costo.
En otras industrias, las aleaciones de iridio también están claramente por delante del metal puro. Los tecnólogos aprecian mucho la capacidad de aumentar la dureza y resistencia de los productos a través de aditivos menores. Por lo tanto, los aditivos de iridio se utilizan para aumentar la resistencia al desgaste del alambre para lámparas electrónicas. El metal sólido se aplica simplemente sobre molibdeno o tungsteno. La sinterización posterior ocurre bajo una prensa, a alta temperatura.


Y aquí debemos mencionar especialmente el uso de iridio en la industria química. Allí, sus aleaciones son necesarias para obtener platos resistentes a diversos reactivos y a altas temperaturas. El iridio también es un excelente catalizador. El aumento de la reactividad es especialmente evidente. en la producción de ácido nítrico. Y si necesita disolver oro en aqua regia, entonces los tecnólogos están casi garantizados para elegir exactamente las copas hechas de aleación de platino-iridio.
Donde cocinan cristales para dispositivos lásera menudo se puede encontrar crisoles de platino iridio. El metal completamente puro es adecuado para piezas de instrumentos industriales y de laboratorio particularmente precisos. Se utiliza la boquilla de iridio y vidrieroscuando necesitan hacer calidades refractarias de vidrio. Pero esto es solo una pequeña parte de las aplicaciones del elemento sorprendente.
A menudo se usa en la fabricación de bujías para automóviles.


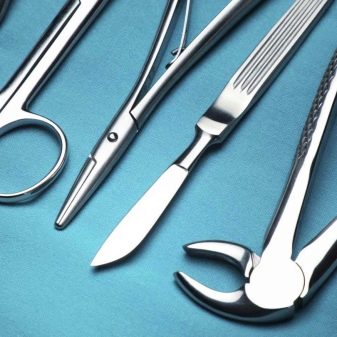
Los expertos han notado durante mucho tiempo que tales velas duran más.. Al principio, se usaban principalmente para autos deportivos. Hoy se han vuelto más baratos y están disponibles para casi todos los propietarios de automóviles. Los creadores también necesitan aleaciones de iridio instrumentos quirurgicos. Cada vez más, también se utilizan en la producción de partes individuales de un marcapasos.
Es curioso que la moneda de "10 francos" producida por Ruanda esté hecha de joyería pura (999 finura) de iridio. Este metal también se usa en catalizadores automotrices. Al igual que el platino, ayuda a limpiar los gases de escape más rápido. Pero puedes encontrar iridio en la pluma estilográfica más común. Allí a veces puedes ver una bola de color inusual, ubicada en la punta de un bolígrafo o barra de tinta.

En componentes de radio, el iridio se usó principalmente hace varias décadas. Los grupos de contacto, así como los componentes que pueden estar muy calientes, se hicieron con mayor frecuencia. Esta solución permite garantizar la durabilidad de los productos.El isótopo iridio 192 es uno de los radionucleidos artificiales. Se produce para el uso de detección de fallas para verificar las características de las soldaduras, aleaciones de acero y aluminio.
Una aleación de osmio con iridio se utiliza para hacer agujas de brújula. Y los termopares, que combinan iridio y electrodos convencionales, se utilizan para la investigación física. Solo ellos pueden registrar directamente una temperatura de aproximadamente 3000 grados. El precio de tales estructuras es muy alto. Usarlos en la industria ordinaria aún no es económicamente factible.


Electrodo de iridio titanio - Uno de los desarrollos relativamente nuevos en el campo de la electrólisis. Se pulveriza una sustancia refractaria sobre una base de lámina de titanio. En este caso, solo el argón está en la cámara de trabajo. Los electrodos pueden verse como una rejilla o una placa. Tales electrodos:
- resistente a altas temperaturas;
- resistente a voltaje significativo, densidad y fuerza de corriente;
- no corroas;
- más económico que los electrodos con la adición de platino (debido a un recurso significativamente más largo).

En metalurgia se demandan pequeños recipientes con isótopos radiactivos de iridio. Los rayos gamma son parcialmente absorbidos por la carga. Por lo tanto, puede determinar cuál es el nivel de carga dentro del horno.
También puede apuntar a aplicaciones del elemento 77 como:
- obtención de aleaciones de molibdeno y tungsteno, más fuertes a altas temperaturas;
- mayor resistencia del titanio y el cromo a los ácidos;
- producción de generadores termoeléctricos;
- fabricación de cátodos termiónicos (junto con lantano y cerio);
- creación de tanques de combustible para cohetes espaciales (en una aleación con hafnio);
- producción de propileno a base de metano y acetileno;
- una adición a los catalizadores de platino para la producción de óxidos de nitrógeno (precursores de ácido nítrico), pero este proceso ya no es muy relevante;
- obtener unidades de medida de referencia (más precisamente, esto requiere una aleación de platino-iridio).

Hechos interesantes
Las sales de iridio son muy diversas en color. Entonces, dependiendo de la cantidad de átomos de cloro unidos, el compuesto puede tener colores rojo cobre, verde oscuro, oliva o marrón. El difluoruro de iridio es amarillo. Los compuestos con ozono y bromo son de color azul. En iridio puro, la resistencia a la corrosión es muy alta incluso cuando se calienta a 2000 grados.
En las rocas terrestres, la concentración de compuestos de iridio es muy baja.. Se eleva seriamente solo en rocas de meteoritos. Tal criterio permite a los investigadores establecer hechos importantes sobre diversas estructuras geológicas. En total, solo unas pocas toneladas de iridio se producen en la tierra.
El módulo de Young (también conocido como módulo de elasticidad longitudinal) de este metal ocupa el segundo lugar entre las sustancias conocidas (más solo grafeno).


Para otras propiedades y aplicaciones de iridio, vea el siguiente video.










