Osmium - un metall rar, pertany al grup del platí. Va ser descoberta a Anglaterra com a resultat d'experiments sobre la reacció del platí. El nom d'osmium es dóna en grec i significa "olor" en traducció. Què és aquest noble metall? Quines són les seves característiques i quin és el seu ús?

La història
El descobriment d’aquest element va ocórrer per casualitat el 1803 pels químics britànics Smithson Tennant i William H. Wallastan. Com a resultat d’experiments sobre la reacció del platí sobre una barreja d’àcids (sulfúric i nítric), el precipitat resultant mostrava una aroma desagradable que recorda la pudor de clor i rave podrit. Experiments similars van ser realitzats per Colle Descotti, Antoine de Fourcoy i Vauclins a França. Com a resultat de les seves investigacions, també van trobar una substància desconeguda en un precipitat insoluble del platí.



A la substància desconeguda se li va donar el nom de pten, però els experiments britànics van demostrar que es tracta de dues substàncies similars: iridium i osmium.
El descobriment d’aquests elements químics va ser presentat a la Royal Society a Londres per un missatge escrit de Tennant amb data del 21 de juny de 1804. A la taula periòdica d’elements químics, el metall es troba sota el número ordinal 76. El metall no es troba en la seva forma pura per nuggets, per tant la seva fórmula química es presenta en forma dissolta.


La mineria d’elements és a partir de materials reciclats. com a resultat de la seva separació d’iridi, platí, mineral de platí-paladiu o minerals de coure i níquel. La producció anual de l’element sencer al món no supera la mida d’una tona.


Dipòsits
Cal destacar els dipòsits més grans del món com ara Muntanyes Urals i Sibèria a Rússia, l’estat del nord Alaska i estat occidental Califòrnia a Amèrica Canadà a Amèrica del Nord Columbia a Amèrica del Sud i alguns Països sud-africans, Austràliailla Tasmània. Actualment, es considera un dipòsit important d’osmium Complex Bushel a Sud-àfrica, hi ha la majoria de coses. Atès que els dipòsits de metalls més grans es troben a Sud-àfrica, els preus mundials d’aquest metall de terres rares són força elevats. Kazakhstan Es considera l’únic important exportador d’osmium-187 al món. Tot i que la Xina té reserves de mineral de platí, no té una quantitat important d’osmi.


La substància s’emmagatzema en forma de pols i com que no es fon en forma de cristalls, no és possible posar-hi marca a causa de les seves propietats físiques. Per a la fabricació de lingots d’aquest metall s’utilitza calefacció per raigs d’electrons o per arc a partir de pols; també s’utilitza la calefacció en un gresol.


Les propietats
L’osmium sembla un metall blau platejat. Aquest és un dels elements més densos, la seva densitat és de 22.600 quilograms per metre cúbic, però al mateix temps, la substància és bastant fràgil, es trenca i es desglaça fàcilment. Té una alta gravetat específica i és capaç de brillar fins i tot a influències de temperatura força elevades. A causa dels paràmetres i la temperatura de fusió significativa, és difícil fer-lo. A la natura, existeix en forma de set isòtops, sis dels quals es consideren estables, es tracta d’osmium-184, osmium-187, osmium-188, osmium-189, osmium-190 i osmium-192. Els isòtops de metall radioactius amb nombres de massa de 162 a 197 es van obtenir de laboratori i també es van obtenir de forma artificial alguns isòmers nuclears.
L’osmi en les seves característiques afecta negativament tots els organismes vius.

Gairebé tots els compostos amb aquest metall causen danys en òrgans interns, trastorns visuals, auditius. En cas d’enverinament per parelles d’osmium, es poden produir trastorns irreversibles al cos i la mort. Els científics van realitzar experiments amb animals, els resultats dels quals van ser el ràpid desenvolupament de l'anèmia, la manca de funció pulmonar normal. Es va concloure que es tracta d’un edema en desenvolupament ràpid. El tetraòxid d’osmi, que s’utilitza en medicina, és una substància molt agressiva. Té l’olor més vil del món. En cas d’enverinament, la pell pateix, canvia de color a verd o negre, sovint això va acompanyat d’úlceres i esquerdes que trigaran molt a cicatritzar-se.

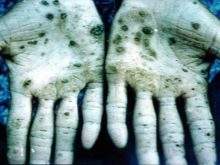

Els empleats dels locals industrials tenen el major risc: segons totes les normes de seguretat, només treballen en respiradors i roba especial. Tots els envasos que contenen òxid d'osmium són segellats i emmagatzemats segons la normativa. Per obtenir minerals de Nevyanskite, el platí es converteix en una solució mitjançant aqua regia. A continuació, el precipitat resultant es tracta amb zinc en una quantitat de 8 vegades - aquest aliatge es converteix relativament fàcilment en un estat en pols, que després es fusiona amb peròxid de bari. El següent pas és el processament de la massa resultant mitjançant aqua regia, destil·lació a través d’un aparell per a la separació de tetròxid d’osmi.

Exposant la substància a una solució alcalina, s’obté sal. La solució salada està afectada hiposulfitCom a resultat, amb l'ajut del clorur d'amoni, el metall precipita ja en forma de sal Fremy. El precipitat es renta, es filtra i es calcina. El resultat de totes aquestes accions és l’osmium esponjós. Posteriorment, es neteja amb àcids, es restaura en un forn elèctric sota un corrent d’hidrogen i es refreda. Així doncs rebre mostres d’osmi fins a un 99,9%.


Química
Les propietats d’aquest element, des del punt de vista de la química, són sorprenents. A continuació, es consideren els més bàsics.
- L’osmium no reacciona en absolut amb àlcalis i àcids. Forma osmata soluble en aigua en reacció amb els fosos alcalins. La interacció amb una barreja d’àcids nítrics i clorhídrics dóna una reacció extremadament lenta.
- Molt tòxic, fins i tot a dosis microscòpiques. És especialment tòxic l’òxid d’osmium alliberat del platí.
- És impossible determinar la temperatura d’ebullició del metall, ja que és especialment refractari.
- El metall en pols reacciona fàcilment amb les substàncies següents: oxigen pur, halògens, àcids sulfúrics o nítrics.
- En diversos compostos rep nombres d'òxids de -2 a +8. Els més comuns són +2, +3, +4 i +8.
- És capaç de formar compostos de clúster.
- Els minerals principals estan relacionats amb solucions sòlides i estan representats per aliatges d’iridi amb osmi - es tracta de la sysertskite i la nevyanskite. A més, el syrskite té un nom diferent - iridium osmium i nevyanskite - osmisty iridium.

Físic
Densitat L’osmium té aproximadament 22,61 grams per centímetre cúbic. Els cristalls tenen una bella brillantor platejada, amb diverses tonalitats del gris al blau. Els lingots presenten un color blau fosc, de color violeta pols. Tot el metall té una brillantor platejada. La toxicitat de l’element no permet el seu ús a la indústria de la joieria. Es noten les principals propietats físiques tals.
- El punt de fusió d’aquest element és força alt, és possible la fusió a una temperatura de més de 3000 graus centígrads.
- El metall no té propietats magnètiques.
- Duresa increïble. Els aliatges amb l'addició d'aquest metall obtenen una major resistència al desgast, durabilitat, anticorrosió i resistència a la tensió mecànica.
- El punt d’ebullició és de 5012 ºC.
- La duresa de Mohs és de 7.
- La duresa de Vickers és de 3-4 GPa.

Camps d'aplicació
A causa del cost important de l’element en si, aquest metall rarament s’utilitza en la producció industrial massiva. L’abast de l’osmium el representa principalment la indústria de la indústria química, on s’utilitza com a catalitzador. El tetraòxid d'osmi s'utilitza com a part d'alguns medicaments. En proves de laboratori, s'utilitza per a tinció de teixits vius, garanteix la preservació de l'estructura cel·lular.
A la indústria aeroespacial s’utilitza l’osmium en equips electrònics d'equips per a tecnologia d'aviació i coets, així com en la fabricació armes nuclears A causa de la manca de propietats magnètiques, el metall s’utilitza en la fabricació de rellotges de marca com Rolex. S'utilitza un aliatge d'osmi amb platí creant implants quirúrgics - Es tracta de marcapasos o vàlvules troncals pulmonars.
A més, l'osmium s'utilitza en microscòpia i per crear dispositius d'alta precisió.



Fets interessants
- A una pressió d'aproximadament 770 GPa, l'osmium interacciona amb els electrons dels orbitals interns, l’estructura de la substància es manté invariable.
- Osmium a les roques conté el mig per cent de la massa total dels dipòsits de mineral.
- Degut a alta densitat l’aspecte i la massa real del metall són molt diferents. Així doncs, una ampolla de plàstic de 0,5 litres plena d'aquesta pols metàl·lica serà més pesada que una galleda de 10 litres plena d'aigua.
- Aquest metall es troba entre els cinc primers llocs costós.
- El cost d’una triple unça d’osmi és un secret comercial, en fonts obertes podeu trobar el preu aproximat per 1 gram de substància.
- Degut a la refractor de l’osmium assenyalat en la història de la làmpada elèctrica. El científic K. Auer von Welsbach, d'Alemanya, va fer una proposta per substituir un filament d'osmi en una bombeta de carbó. Les bombetes van resultar ser tres vegades menys energètiques i la il·luminació va millorar notablement. És veritat, aviat va ser substituït pel tàntal més comú, que al seu torn va ser substituït per tungstè.
- Una situació similar va ocórrer amb la producció de metalls rars i en l'amoníac. El mètode de síntesi d’amoníac que s’utilitza actualment, desenvolupat el 1908 pel químic Fritz Haber d’Alemanya, és impossible sense l’ús de catalitzadors.Inicialment, els catalitzadors utilitzats en aquell moment mostraven les seves propietats només en presència de condicions de temperatura significatives i no tenien alta eficiència, per la qual cosa la recerca d’un reemplaçament era molt rellevant. Científics del laboratori de l'Escola Tècnica Superior de Karlsruhe han proposat l'ús d'osmi finament dispers en forma d'element catalític. Els resultats de les proves van confirmar que aquesta idea valia la pena, la temperatura catalítica va disminuir més de 100 ºC i la producció d'amoníac va augmentar significativament. És cert que després van refusar l'osmium, però van ajudar a resoldre un problema tan important.

Juguen l'osmi i altres metalls rars i únics paper important en diverses indústries. Fins i tot amb tota la seva toxicitat, salva la vida i la salut de les persones.
Podeu obtenir més informació sobre l’osmium al següent vídeo.










